02.05.2022 Erstellt von LAMBDA Laboratory Instruments
Kürzlich sind wir auf eine Studie von der Heinrich-Heine Universität (HHU) in Zusammenarbeit mit der Universität Bielefeld und Photanol B.V. zur Forschung mit dem Modellmikroorganismus Cyanobakterium Synechocystis sp. PCC 6803 gestossen. Die HHU beschreibt in ihrer Veröffentlichung den Versuchsaufbau eines modularen Photobioreaktors LAMBDA MINIFOR PBR 1L mit bereits im Labor vorhandenen Peripheriegeräten und Sonden:
Modellcyanobakterium Synechocystis sp. PCC 6803 im modularen Labor-Photobioreaktor
doi.org/10.1101/2021.07.26.453758 Fig S7 aus der Volltextversion, Bild mit freundlicher Genehmigung der HHU Düsseldorf, Louis Goldschmidt. Uncoupling of the Diurnal Growth Program by Artificial Genome Relaxation in Synechocystis sp. PCC 6803. Anna Behle, Maximilian Dietsch, Louis Goldschmidt, Wandana Murugathas, David Brandt, Tobias Busche, Jörn Kalinowski, Oliver Ebenhöh, Ilka M. Axmann, Rainer Machné. bioRxiv 2021.07.26.453758
Die Forscher der HHU manipulierten das DNA-Supercoiling im Cyanobakterium Synechocystis sp. PCC 6803 mit Hilfe des CRISPRi-basierten Knock-downs der Schlüsselgene, die in der Verformung des Supercoilings beteiligt sind, der Gyrase-Untereinheiten (Genuntereinheiten: gyrA und gyrB) und der induzierbaren Überexpression von Topoisomerase I (= TopoI; Gen: topA). Anschliessend wurden die Phänotypen der Cyanobakterien charakterisiert. Der modifizierte Stamm wurde hierzu in einem LAMBDA MINIFOR PBR 1L Photobioreaktor kultiviert.
-
Photobioreaktor & Parameter
Welche Versuchsparameter wurden im Bioreaktor gemessen und/oder geregelt?
-
Versuchsergebnisse der HHU
Wie ist S. sp. PCC 6803 nach der Modifikation gewachsen?
-
Synechocystis sp. PCC 6803
Um welche Gattung von Cyanobakterien handelt es sich
und wie wird Synechocystis im Labor kultiviert? -
Cyanobakterien & Licht
Phototaktische Bewegungen, LD Zyklen und die Circadiane Uhr – was ist das?
-
Supercoiling & Molekularbiologie
Wie wurde das Modellbakterium molekularbiologisch verändert und damit sein Supercoiling beeinflusst?
-
Referenzen & Informationen
Weitere Informationen zum Thema Cyanobakterium Synechocystis
Welche Versuchsergebnisse beschreiben die Forscher der HHU auf doi:10.1101/2021.07.26.453758?
Die modifizierten Cyanobakterien Synechocystis sp. PCC 6803 zeigten eine blockierte Zellteilung. Die Forscher vermuteten als Grund nicht die Inhibition der Plasmid-DNA-Replikation, sondern die Hemmung der genomischen Replikation.
Das Zellwachstum ging mit einem vier- bis fünffachen Zellwachstum im Vergleich zum Wildtyp weiter und der metabolische Fluss im TopoI-Überexpressionsstamm wurde in Richtung Glykogen umgeleitet.
Zunächst führte die TopoI-Induktion zu einer Down-Regulation (Herunterregulation) der GC-reichen Genen und einer Up-Regulation (Hochregulation) der AT-reichen Genen. Die Reaktion verzweigte sich schnell, und die vier täglichen Koexpression-Kohorten (Morgendämmerung, Mittag, Abenddämmerung und Nacht) des circadianen Musters (≈ 24 h) reagierten alle unterschiedlich. Eine GC-reiche Region − 50 bp der Transkriptionsstartpunkten (TSP) wurde in diesen vier Kohorten unterschiedlich angereichert.
Die Forscher schlugen ein Model vor, bei dem die energie- und gyrasegesteuerte Transkription der Wachstumsgene während des Dunkel/Licht-Übergangs (Dämmerung) das DNA Supercoiling (Superspiralisierung) generiert, welches dann die DNA-Replikation erleichtert und das tägliche Transkriptomprogramm einleitet.
Die Forscher der HHU bestätigen in dieser Arbeit in Synechocystis sp. PCC 6803 sowohl das Homöostase-Model als auch das transkriptionsabhänige Supercoiling-Model.
Sämtliche Manipulationen zur Verringerung des Supercoilings führten zur Ausprägung unterschiedlicher phänotypischer Merkmale durch ein einzelnes Gen (ausgeprägten pleiotropen Phänotyp), bei dem die Zellteilung blockiert worden ist und das Zellwachstum weiterlief.
Insbesondere eine topA Überexpression induzierte einen Overflow-Metabolismus und die Glykogenproduktion und entkoppelt das tägliche Transkriptionsprogramm. Metabolismus und Transkriptom (Gesamtheit aller in einem Bakterium hergestellten RNA-Moleküle) schienen zwischen später Nacht und frühem Morgen blockiert zu sein.
Cyanobakterien: Modellmikroorganismen Synechocystis sp. PCC 6803
Cyanobakterien („Blaugrünbakterien“, früher als Blaualgen oder Cyanoprokaryoten bezeichnet) sind gramnegative, photosynthetisch aktive Mikroorganismen, die effektive Mechanismen zur Besiedelung von äusserst vielfältigen Habitaten entwickelt haben. Die Morphologie der Cyanobakterien reicht demnach von einzelligen Mikroorganismen bis hin zu multizellularen filamentösen Zellverbindungen.
Gattung Synechocystis
Die Gattung Synechocystis sind mesophile, einzellige, kokkoide photosynthetisch aktive, nicht-diazotrophe Süsswasser-Cyanobakterien, die elementaren Sauerstoff (O2) produzieren, jedoch kein Stickstoffgas fixieren. Synechocystis vermehren sich durch binäre Einschnürung ohne Aggregate zu bilden, und besitzen keine Zellscheiden.
Spezies Synechocystis sp. PCC 6803 ist ein Modellmikroorganismus
Die Spezies Synechocystis sp. PCC 6803 (S. sp. PCC 6803) ist ein einzelliger Modellmikroorganismus (ursprünglich 2-3 µm im Durchmesser) und dient als bekanntes Modellcyanobakterium zur Erforschung der oxygenen Photosynthese, denn ihr Photosyntheseapparat wie der photosynthetische Elektronentransportmechanismus sind dem der Landpflanzen sehr ähnlich.
Das Bakterium ist zudem zur Mixotrophie fähig, d.h. es betreibt sowohl Phototrophie (CO2 Assimilation) als auch Chemotrophie (Verwertung organischer Stoffe). Dank dem chemoheterotrophen Wachstum dieser Modellmikroorganismen können in der Molekularbiologie essentielle Gene der Photosynthese vollständig inaktiviert und die Auswirkungen erforscht werden.
(Siehe auch uni-koeln.de/math-nat-fak/biochemie/kraemer/projekte/cyano/cyano2/model.htm)
S. sp. PCC 6803 in der Molekularbiologie
Der Modellmikroorganismus Synechocystis sp. PCC 6803 zeigt eine sehr niedrige Wachstumsrate. Weil S. sp. PCC 6803 jedoch leicht exogene DNA aufnimmt und sich so transformieren lässt, werden die DNA-Klonierungen z.B. im schnellwachsenden E. coli vorgenommen und später als Shuttle-Plasmide in Synechocystis eingebaut.
Kultivierung vom Cyanobakterium Synechocystis sp. PCC 6803
Im Labor werden Synechocystis sowohl auf Agarplatten als auch in Flüssigkulturen kultiviert.
Zur Studie von Synechocystis sp. PCC 6803 im Photobioreaktor von Forschungslabors werden in unterschiedlichen Publikationen als ideale Wachstumsbedingungen im Flüssigmedium die BG-11-Salzlösung (siehe bitte www.dsmz.de/microorganisms/medium/pdf/DSMZ_Medium1593.pdf ) mit pH 7.0 – 8.5 eine Lichtintensität von 50 μmol Photonen m−2s−1 und eine mit 1 – 2 % CO2 angereicherte Belüftung beschrieben.

Lichteinfall und phototaktische Bewegung von Cyanobakterien
Cyanobakterien nehmen die Richtung des Lichteinfalls wahr. Synechocystis sp. PCC 6803 reagiert auf unterschiedliche Beleuchtungsstärken bzw. auf Beleuchtungsstärkegradienten mit einer phototaktischen Motilität.
- Positive Phototaxis: Synechocystis bewegen sich mit Hilfe ihrer Pili auf das vorteilhafte Rot- und Grünlicht zu.
- Negative Phototaxis: Die Cyanobakterien bewegen sich vom schädlichen UV-Licht weg.
Einfluss von Licht / Dunkel (L/D) auf den Energiestoffwechsel vom Bakterium S. sp. PCC 6803
Durch die Manipulation von Photorezeptoren kann die Bewegungsfreudigkeit der Cyanobakterien verändert werden.
- Während der Lichtphase ist das Bakterium S. sp. PCC 6803 autotroph:
Das Bakterium benutzt Licht (im natürlichen Habitat die Sonnenenergie) als Energiequelle (Photoautotrophie), um für seinen phototrophen Energiestoffwechsel atmosphärischen Kohlenstoffdioxid (CO2 als anorganische Kohlenstoffverbindung) abzubauen und elementaren Sauerstoff (O2) zu produzieren.
Während der Photosynthese erzeugt das Cyanobakterium ATP und NADPH, um Nährstoffe zu assimilieren und CO2 über den Calvin-Benson-Zyklus zu fixieren. Die Lichtreaktion (Photolyse von Wasser) findet in und/oder an der Thylakoidmembran der Cyanobakterien statt.
- Während der Dunkelphase ist S. sp. PCC 6803 heterotroph:
Das Bakterium zeigt heterotrophes aerobes Wachstum durch Glykolyse (Abbau von Einfachzuckern) und oxidative Phosphorylierung (Energiegewinnung in Form von ATP).
Licht/Dunkel-Zyklus (LD Zyklus), Circadiane Uhr und Genexpression
Cyanobakterien folgen einer 24-stündigen Oszillation, auch wenn mehrere Tage konstante Lichtbedingungen herrschen.
Die ansonsten bei Prokaryoten fehlende Circadiane Uhr ermöglicht den Cyanobakterien eine vorausschauende Regulation, d.h. sie können ihre Photosynthese-Gene bereits vor Beginn der Lichtphase transkribieren und dadurch schon zu Beginn der Lichtphase für die Photosynthese bereit sein.
Durch die circadianen Rhythmen regulierte Genexpression stellen sich Cyanobakterien also optimal auf die Phasenübergänge im Tag/Nachrhythmus ein.
DNA Supercoiling
Die DNA von Bakterien liegt in vivo als extrem gepackte, spiralisierte Doppelhelix vor, dem negativen Supercoiling (negativer Supertwist). Dank der platzsparenden rechtsgängigen Verdrillung passt die DNA Doppelhelix überhaupt erst in das Bakterium (siehe bitte die Abbildung www.biorxiv.org/content/10.1101/2021.07.26.453758v2.full#F1 der HHU).
Das DNA Supercoiling in Cyanobakterien variiert mit dem täglichen Licht/Dunkel-Zyklus und ist in zeitliche Programme der Transkription und Replikation integriert. Das Supercoiling ist während der exponentiellen Wachstumsphase (starker metabolischen Fluss) besonders hoch. [1]
Enzyme und Molekularbiologie: CRISPR-Cas-Systeme / CRISPRi, Topoisomerase I (TopoI) und Gyrase
Mehr Basisinformation zu den Enzymen und den Hintergründen des Supercoilings / Genom(in)stabilität bzw. der in der Studie der HHU verwendeten molekularbiologischen Methoden finden Sie unter anderem auf Wikipedia:
- CRISPR-Cas-System / CRISPRi:
www.de.wikipedia.org/wiki/CRISPR#Adaptation ; - Topoisomerase I (TopoI):
www.de.wikipedia.org/wiki/Topoisomerase#Topoisomerase_Typ_I ;
enzyme.expasy.org/EC/5.6.2.1 ; - Gyrase:
www.de.wikipedia.org/wiki/Gyrase .
Die molekularbiologische Methodik im Versuch mit Synechocystis sp. PCC 6803 wird von der HHU und Partnern auf www.biorxiv.org/content/10.1101/2021.07.26.453758v2.full#F15 (02. Mai 2022) im Kapitel „Materials and Methods“ beschrieben.
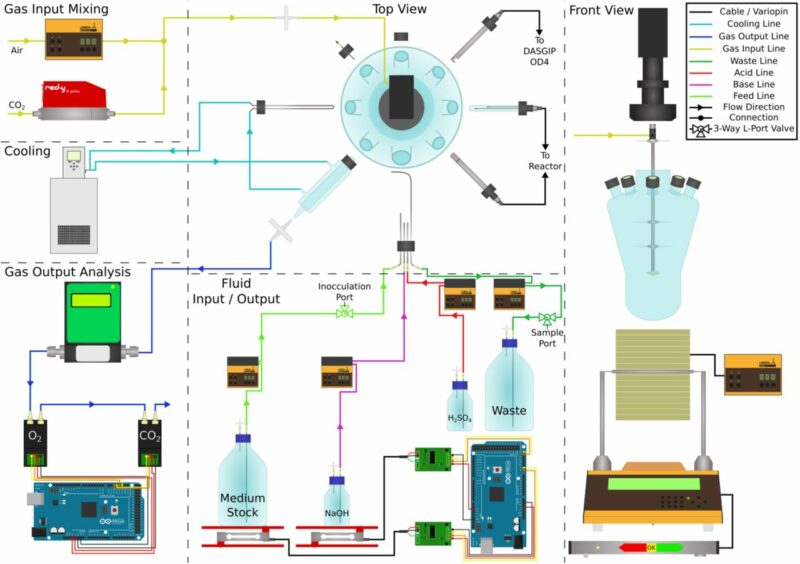
Der modulare Photobioreaktor für Cyanobakterien
Als Photobioreaktor für die modifizierten Cyanobakterien verwendeten die Forscher der HHU den modularen LAMBDA MINIFOR PBR 1L und für die erweiterten Mess- und Regelsysteme bereits vorhandene Peripheriegeräte, sowohl von Drittanbietern als auch von LAMBDA Laboratory Instruments.
Der Photobioreaktor LAMBDA MINIFOR PBR wurde zur Messung und automatischen Regelung von pH (pH = 8), Temperatur (30 °C), pO2 und Mischung (5 Hz) der Flüssigkultur (1 Liter) eingesetzt. Das bereits vorhandene DASGIP OD4 Gerät zur Messung der optischen Dichte konnte ebenfalls an den modularen Photobioreaktor angeschlossen werden, genau wie die Massendurchflussmesser für die Zuluft (1 L/min mit 0.5 % CO2 angereicherter Luft) bzw. für die Abluft und die Messgeräte für die O2 und CO2 Konzentrationen in der Abluft.
Zur kontinuierlichen Kultur (φ ≈ 0.24 d−1) wurden LAMBDA Mediumpumpen (Fütterungs- und Aberntepumpe) sowie das LAMBDA Waagemodul für die Konstanthaltung des Kulturgewichts für den Chemostat eingesetzt. Der Verbrauch von Medium und NaOH wurden erfasst und quantifiziert.
Als Leuchtquelle diente warm-weissen LED. Die Regelung der Lichtintensität erfolgte mit dem LAMBDA LUMO Modul.
Inokulum
Cyanobakterium Synechocystis sp. PCC 6803, topAOX Stamm
- 100 ml Vorkultur, OD750nm ≈ 0.5
Flüssigmedium im Photobioreaktor
- Medium BG11 + Antibiotika
- Kulturvolumen 1L
Chemostat im Photobioreaktor: mit LAMBDA Schlauchpumpen und Waagemodul
Die kontinuierliche Cyanobakteriumkultur mit Verdünnungsrate φ ≈ 0.24 d−1 wurde ab OD750nm ≈ 2.9 gewichtsgesteuert als Chemostat eingeleitet:
Eine LAMBDA Schlauchpumpe förderte die Flüssigkultur mit konstanter Geschwindigkeit aus dem Reaktor, während zeitgleich die LAMBDA Fütterungspumpe kontinuierlich frisches Medium der Bakterienkultur zufügte.
Um während der kontinuierlichen Kultivierung das Gewicht der Bakterienkultur im Reaktor stabil zu halten, wurde das LAMBDA Waagemodul eingesetzt:
Bei einer Gewichtsänderung der Flüssigkultur im Photobioreaktor aktiviert das Waagemodul vollautomatisch die Fütterungspumpe, um frisches Kulturmedium in den Reaktor zu pumpen.
In der Batchphase wurde die Ansteuerung der Fütterungspumpe ebenfalls vollautomatisch mit dem LAMBDA Waagemodul bewerkstelligt, um die verdampfte Flüssigkeit zu ersetzten und so das Kulturgewicht konstant zu halten.
Peripheriegeräte für die kontinuierliche Kultur mit konstantem Volumen:
- Mediumpumpe
- Aberntepumpe
Peripheriegeräte für die kontinuierliche Kultur mit konstantem Gewicht (Chemostat):
- LAMBDA Waagemodul für LAMBDA MINIFOR Chemostaten
- Fütterungspumpe: manuell eingestellte konstante Flussrate
- Aberntepumpe durch Waagemodul automatisch angesteuert.
Zuluft für Cyanobakterium Synechocystis sp. PCC 6803
- Belüftungsrate = 1 L/min mit 0.5 % CO2 angereicherter Luft
Die Einzelgase zur Belüftung des Photobioreaktors wurden wie folgt kontrolliert:
- Luft: LAMBDA MASSFLOW 5000 Massendurchflussmessgerät für Gas
- Kohlenstoffdioxid (CO2) Vögtlin red-y smart controller Massendurchflussmesser
Die Zuluft wurde mit Hilfe des im Photobioreaktors eingebauten selbstreinigenden Mikrospargers in das Flüssigmedium eingebracht.
Mischung & Rührung im Photobioreaktor
Für den Stoffaustausch ist eine gute Durchmischung der Flüssigkultur im Photobioreaktor äusserst wichtig:
- LAMBDA FiSH-TAIL Vibromischung (eingebaut) = 5 Hz
Temperaturregelung
Die Temperatur des flüssigen Kulturmediums wurde mit dem im LAMBDA MINIFOR PBR Photobioreaktor eingebauten Infrarot-Heizelement geregelt.
- Temperatur: 30 °C
Die Flüssigkeit für den Kühlkreislauf durch die LAMBDA Kühlschleife für das Kulturmedium bzw. durch den Glaskondenser für die Abluft wurde vom Lauda Eco Silver Thermostat (Einstellung 16 °C) bereitgestellt.
- Temperaturkontrolle
- Messung: Pt100 Messfühler (in der pH Sonde eingebaut)
- Regler: Im LAMBDA MINIFOR Photobioreaktor eingebauter Temperaturregler
- Stellglied: LAMBDA MINIFOR IR-Modul (Infrarotstrahlung)
pH-Regelung von LAMBDA MINIFOR
Für die automatische pH-Regelung auf pH 8.0 kam der im LAMBDA MINIFOR PBR Photobioreaktor eingebaute pH Regler und pH-Sonde zum Einsatz. Mit Hilfe der beiden LAMBDA PRECIFLOW Pumpenlinien wurden die Säure (0.5 M H2SO4) und Base (0.5 M NaOH) automatisch dosiert, um den pH auf 8.0 konstant zu halten. Der Verbrauch von NaOH wurde erfasst und die Flussraten ermittelt.
pO2
Während der Kultivierung der Cyanobakterien wurde auch laufend der pO2 (gelöster Sauerstoffgehalt im Kulturmedium) gemessen.
Die Forscher der HHU bevorzugten es, ihre bereits vorhandene optische pO2 Sonde (Visiferm Hamilton) anstelle einer neuer LAMBDA PEEK pO2 Elektrode einzusetzen. Hierzu wurde einfach der entsprechende Temperaturkompensationskoeffizient für die gewählte Sonde am modularen Bioreaktor LAMBDA MINIFOR eingegeben.
Geregelte Lichtintensität (LED warm-weiss)
Die Beleuchtung der Cyanobakterienkultur erfolgte mit dem LAMBDA LUMO Modul zur Regelung der Lichtintensität. Als Leuchtquelle diente warm-weissen LED, die am LAMBDA Glasreaktorgefäss angebracht worden ist.
Zu Beginn des Prozesses im Photobioreaktor wurde eine Rampe von 42 auf 250 Photonen gefahren und dann konstant gehalten. Anschliessend wurde die Lichtintensität manuell auf etwa ∼90 µmol/(m2*s) per OD750nm angepasst, um die Pflanzen während dem Biomassenabbau vor Starklichtstress zu schützen.
Sobald vom kontinuierlichen Prozess auf Batch umgestellt wurde, wurde auch die Lichtintensität wieder als Rampe von 70 auf 250 µmol/(m2*s) erhöht.
(Das Lichtprofil wird auf www.biorxiv.org/content/10.1101/2021.07.26.453758v2.full (2. Mai 2022) in Figure S8 / Graph F aufgezeichnet: biorxiv.org/content/biorxiv/early/2021/08/29/2021.07.26.453758/F16.large.jpg )
Wie wurde das Licht kalibriert?
Das Licht wurde mit einem Licor-Belichtungsmesser (LI-250A) mit einer kugelförmigen Sensorbirne (LI-193) zur Lichtintensität in µmol*m−2s−1 kalibriert (Siehe bitte Abb. S8E- F auf doi.org/10.1101/2021.07.26.453758 )
Abluftmessungen
Auch zur Abluftmessung wurden bereits vorhandene Messgeräte an den modularen Photobioreaktor LAMBDA MINIFOR PBR angeschlossen:
Die Flussrate der Abluft wurde mit dem vorhandenen Aalborg Massflow Messgerät aufgezeichnet und dann der O2 & CO2 Gehalt der Abluft mit einem benutzerdefinierten Mikrocontroller-basierten Gassensor-Array gemessen.
Zellzahl und Zellgrösse: Trübungsmessung, OD750nm, CASY, Trockengewicht
Die Wachstumsveränderungen – sowohl Zellzahl als auch Zellgrösse – des modifizierten Modellorganismus wurde dank unterschiedlichen Methoden aufgezeigt.
Die HHU beschreibt in doi.org/10.1101/2021.07.26.453758 die Methode, eine Korrelation zwischen der Trübungsmessung und dem externen Zellzählen mit dem CASY Zellzähler zu finden.
Optische Dichte / Trübungsmessung (inline)
Während der Kultivierung im Photobioreaktor diente ein DASGIP OD4 Gerät der Trübungsmessung. Das inline Signal der Sonde wurde mit einer offline OD750nm Messung kalibriert (siehe bitte Abb. S8 von doi.org/10.1101/2021.07.26.453758)
CASY Zellzähler (offline Messung): tote Zellen, vitale Zellen, Partikelgrösse
Der CASY Zellzähler ermöglicht das erfassen der Lebend- und Totzellzahl einer Probe aus dem Bioreaktor. Zudem ermöglicht das Analysegerät die Partikelgrösse zu erfassen. www.labconsulting.at/produkt/casy-cell-counter-2-2/
Trockengewicht der Zellen (CDW, cell dry weight)
Nebst der täglichen OD750nm Messung anhand einer Probe aus dem Bioreaktor wurde am Ende des Tages im Labor auch das Trockengewicht der Zellen bestimmt.
Quellen und weitere Informationen zum Modellcyanobakterium Synechocystis sp. PCC 6803
- [1] Uncoupling of the Diurnal Growth Program by Artificial Genome Relaxation in Synechocystis sp. PCC 6803. Anna Behle, Maximilian Dietsch, Louis Goldschmidt, Wandana Murugathas, David Brandt, Tobias Busche, Jörn Kalinowski, Oliver Ebenhöh, Ilka M. Axmann, Rainer Machné.
bioRxiv 2021.07.26.453758; doi: https://doi.org/10.1101/2021.07.26.453758 - Modulare Laborbioreaktoren:
www.lambda-instruments.com/de/bioreaktor-laborfermenter/ (2. Mai 2022) - Medium BG11+ für Cyanobacterium:
dsmz.de/microorganisms/medium/pdf/DSMZ_Medium1593.pdf (2. Mai 2022) - STRING Datenbank:
https://string-db.org/
Videos und Bilder zu Synechocystis:
- Lichteinfall und phototaktische Bewegung von Synechocystis , Video
youtube.com/shorts/AMcnTOFaqA8 (2. Mai 2022) - Photosynthese / Lichtreaktion, Video
youtu.be/fQd2Lo4-EhE (2. Mai 2022) - Transformation im Cyanobakterium Synechocystis PCC 6803, Video
youtube.com/watch?v=aTq8wS0PKyc (2. Mai 2022) - Schematische Darstellung von Synechocystis (Querschnitt), Bild
de.wikipedia.org/wiki/Synechocystis#/media/Datei:Synechocystis.svg - Der Modellstamm Synechocystis sp. PCC 6803, Bild
uni-koeln.de/math-nat-fak/biochemie/kraemer/projekte/cyano/cyano2/model.htm
Weitere Literatur & Studien zu Cyanobakterien:
- Synechocystis PCC 6803:
geb.uni-giessen.de/geb/volltexte/2008/5786/pdf/DrathMiriam-2008-04-10.pdf (2. Mai 2022) - Cyanobakterieller Stoffwechsel:
doi.org/10.18452/17055 - Cyanobakterien und Chloroplasten:
geb.uni-giessen.de/geb/volltexte/2012/8904/pdf/WallnerThomas_2012_07_11.pdf (2. Mai 2022) - Zeitliche Koordination in Cyanobakterien:
doi.org/10.18452/17252 - Regulation und Stressadaption in Cyanobakterien:
doi.org/10.18452/20459 - Photoautotrophe Mikroorganismen & Kultivierungen im Labor- und Pilotmassstab
doi.org/10.5445/IR/1000084996


