Kürzlich sind wir auf eine Studie gestossen, die die Herstellung von Rhamnolipid (RL) mit Pseudomonas aeruginosa im Laborfermenter LAMBDA MINIFOR 7L und die Aufarbeitung des Sekundärmethaboliten im Überstand beschreibt. Zudem haben wir gelernt, dass das Biotensid Rhamnolipid auch zytotoxischen Eigenschaften aufweist.
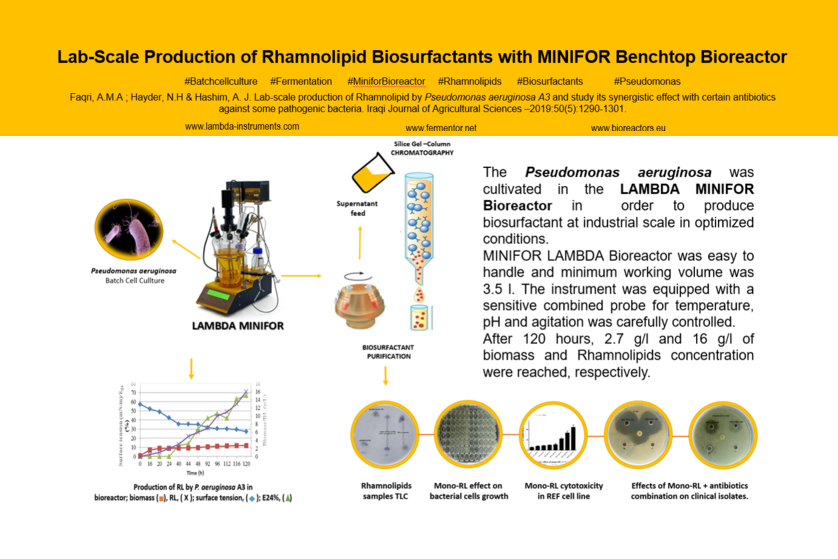
DOI 10.13140/RG.2.2.10802.35520 : Die Produktion des Biotensids Rhamnolipid mit Pseudomonas aeruginosa im Laborfermenter LAMBDA MINIFOR, Aufarbeitung des Überstands im DSP und die Zytotoxizitätstests von Mono-Rhamnolipiden in Kombinationswirkung mit Antibiotika: Studie des Bagdad University College of Science (2019)
11.05.2021 Erstellt von LAMBDA Laboratory Instruments
Biotenside Rhamnolipide (RL) werden mikrobiell mit Pseudomonas aeruginosa im Fermenter hergestellt
Biotenside sind mikrobiell hergestellte, oberflächenaktive Tenside und werden unter anderem in Wasch- und Reinigungsmitteln eingesetzt. Die im Fermenter hergestellte Biotenside sind eine vielversprechende Alternative zu den herkömmlichen petrochemisch synthetisierten Tensiden:
Welche Vorteile bieten Biotenside gegenüber synthetischen Tensiden?
Die Vorteile der Biotenside aus der industriellen Biotechnologie gegenüber den synthetischen Tensiden beziehen sich nebst dem hohem tensidischen Wirkungsgrad (gute Waschleistung) auch auf die Umwelt.
- Herstellung auf Basis nachwachsender Rohstoffe oder Abfallstoffen aus Produktionsanlagen: Pflanzenöle, Zuckersubstrat (Dicksaft oder Melasse)
- Geringere Toxizität
- Gute biologische Abbaubarkeit
- Gute pH und Salzgehaltbedingungen
Rhamnolipide (RL) sind oberflächenaktive Biotenside
Die von Pseudomonas aeruginosa produzierten oberflächenaktiven Rhamnolipide (RL) gehören zur Gruppe der Glykolipide und setzen wie folgt zusammen:
- aus Mono-Rhamnolipide (eine Rhamnose-Einheit),
- aus Di-Rhamnolipide (zwei Rhamnose-Einheiten) und
- einer bis drei β-Hydroxyfettsäuren (gesättigt oder ungesättigt, Kettenlänge 8 – 16 Kohlenstoffatome).
Pseudomonas aeruginosa ist das Bakterium zur Herstellung von Rhamnolipid (RL)
Das Bakterium Pseudomonas aeruginosa produziert mit Hilfe der Enzyme Rhamnosyltransferasen das Biotensid Rhamnose-Lipide (Rhamnolipid, RL) in signifikanten Mengen.
Unter limitierenden Wachstumsbedingungen (Eisen-, Phosphat- oder Stickstofflimitierung) produziert P. aeruginosa auf Pflanzenölen die Rhamnolipide (RL):
Durch die Ausscheidung des RL in das Kulturmedium, wird das Pflanzenöl emulgiert und anschliessend durch Lipasen in Glycerid und Fettsäure gespalten.
Forscher Noordman & Janssen (1) haben bereits im Jahr 2002 vermutet, dass P. aeruginosa mit Hilfe der RL schlecht wasserlösliche Substrate aufnehmen und dann abbauen. A.V. Sotirova hat 2008 eine Studie (2) durchgeführt, die die antimikrobielle Wirkung der vom Bakterium produzierten Rhamnolipide nachgewiesen hat, indem RL die Oberflächenspannung des umgebenden Wassers herabsetzt.
«P. aeruginosa ist ein gramnegatives, oxidasepositives, 2 – 4 µm grosses Stäbchenbakterium mit büscheligen lophotrichen Flagellen der Gattung Pseudomonas. Mit seinen Haftfimbrien setzt sich das Bakterium auch an Oberflächen fest.»
Rhamnolipidsynthese mit Pseudomonas aeruginosa und Quorum Sensing (QS)
Die Rhamnolipidsynthese von P. aeruginosa ist Quorum Sensing (QS) reguliert. (Leitermann, F. P. (3)) Das Quorum Sensing regelt auf transkriptioneller Ebene die Produktion der Rhamnolipide (Van Delden & Iglewski, (4)).
«Durch Quorum Sensing wird das Verhalten von Bakterien der einen Art in einer Suspension gesteuert, indem bestimmte Gene nur dann aktiviert werden, wenn eine bestimmte Zelldichte über- oder unterschritten wird. »
Pseudomonas aeruginosa ist bereits seit 1983 als opportunistisch human-pathogener Keim eingestuft (Bodey et al. (5)) und gehört zur Risikogruppe 2. Die Produktion von RL Biotensiden ist somit mit den entsprechenden technischen Sicherheitsmassnahmen verbunden.
«Pseudomonas aeruginosa ist als opportunistisch human-pathogener Keim eingestuft.»

Vom Umgang mit gefährlichen Mikroorganismen der Risikogruppe 2
Auch die Forscher Ayoob Alshaikh Faqri, Nadhem Hayder & A. J. Hashim des Bagdad University College of Science (doi.org/10.13140/RG.2.2.10802.35520, (6)) haben sich zum leichterten Umgang mit den gefährlichen Mikroorganismen für den Laborfermenter LAMBDA MINIFOR entschieden:
LAMBDA MINIFOR Laborfermenter für den leichteren Umgang mit pathogenen Bakterienkulturen
LAMBDA MINIFOR Laborfermenter bieten im Umgang mit pathogenen Bakterien entscheidende Vorteile:
- Minimale Stellfläche (ab 35 ml bis 6 Liter Arbeitsvolumen) für den Einsatz in begrenzter, kontrollierter Umgebung: Reinräume, S2 klassifizierte Räume bis hin zu Glove-Box oder Sterilbench
- Einfache Desinfektion & Reinigung der glatten und lösungsmittelresistenten Oberflächen
- Einfach zu handhabendes Steril-Handling dank den sehr gut zugänglichen und übersichtlichen Kutlurgefässen
- Einfache Abtötung der pathogenen Versuchskulturen durch die Sterilisation der autoklavierbaren Reaktorgefässe, Sonden und Zugängen.
Wie vereinfacht die Konstruktion von LAMBDA MINIFOR Laborfermenter das sterile Handling?
LAMBDA MINIFOR Laborfermenter vereinfachen dank einer äusserst übersichtlichen Konstruktion das sterile Handling. Sogar der Infrarotstrahler (IR) der Temperaturregelung ist im geschützten Gehäuse unterhalb des Reaktorgefässes eingebracht. Die Konstruktion beengt den Labortechniker nicht durch heisse Oberflächen und lässt dem Forscherteam jederzeit vollen Einblick in das Ganzglasgefäss.
Im Weiteren sind alle Anschlüsse ergonomisch angebracht und die Kabel minimiert – so sind z.B. Steuerung und Stromversorgung der Peripheriegeräte im gleichen Kabel untergebracht und ganz einfach an die Konsole des Laborfermenters einsteckbar. Der Techniker erhält damit im Gegensatz zu herkömmlichen Fermentern einen freien, übersichtlichen Zugang zu sämtlichen Ports.
Die Herstellung der Rhamnolipide mit Hilfe von P. aeruginosa im Laborfermenter
Um signifikante Mengen des Biotensids Rhamnolipid (RL) aus Pseudomonas aeruginosa für die Aufarbeitung herzustellen, haben die Forscher Ayoob Alshaikh Faqri, Nadhem Hayder & A. J. Hashim des Bagdad University College of Science das fünftägige Batch-Verfahren im Laborfermenter LAMBDA MINIFOR 7L gewählt (6):
Produktionsmedium:
- Proteose-Pepton-Ammoniumsalze (PPAS) Medium, autoklaviert
+ C-Quelle: 2.5 % Glyzerin (C3H8O3), steril - + Spurenelemente, sterilfiltriert
Die genauen Zusammensetzung und Herstellung des Fermentationsmediums finden Sie in der wissenschaftlichen Publikation auf doi.org/10.13140/RG.2.2.10802.35520 (6).
Inokulum:
- 70 ml Produktionsmediums (2 %) mit 1 × 10E6 KbE/ml
LAMBDA MINIFOR Bioreaktoren bieten mehrere Möglichkeiten zum Animpfen:
- Für volumenreiche Vorkulturen: Die Schlauchverbindung über einen sterilen Port;
- Für die Inokulation kleiner Volumen in Spritzen: das sterile Septum.
Verfahren & Volumen:
- Batch Verfahren mit Arbeitsvolumen 3.5 Liter
- Dauer des Versuchs: 120 h
Geregelte Hauptparameter
- Temperatur 30 °C
- pH = 6.5
Die proportionalen Parameterregler im Laborfermenter sind wichtig!
Eine proportionale Parameterregelung heisst beim Laborfermenter, dass anhand der Abweichung zwischen Ist- und Sollwert eines Parameters das Stellglied (Pumpe, MASSFLOW-Ventil, Heizelement …) über den gesamten Bereich proportional angesteuert wird:
- Ist die Abweichung zwischen Ist- und Sollwert gross,
wird mit hoher Geschwindigkeit Korrekturflüssigkeit zum Fermentermedium gepumpt; - Ist die Abweichung klein,
wird mit kleiner Geschwindigkeit gepumpt
Der proportionale Regler hilft, den Sollwert des Parameters schnell und auf den Punkt genau zu erreichen.
Beispiel: pH-Regler
Der Laborfermenter LAMBDA MINIFOR regelt den pH des Kulturmediums während allen Phasen der Kultivierung von P. aeruginosa äusserst schnell und zuverlässig: Die proportionale Regelung von LAMBDA MINIFOR steuert die Schlauchpumpen für Säure / Base über deren gesamten Geschwindigkeitsbereich proportional zur Abweichung zwischen aktuellem Ist-Wert und zuvor eingegebenen Sollwert an.
Ausbeute aus dem 7L Laborfermenter für die Aufarbeitung
Nach 120 Stunden im Fermenter hat die Fermentationsbrühe folgende Werte erreicht:
- 7 g/L Biomassenkonzentration
- 16 g/L Rhamnolipidkonzentration
- 2 mN/m Oberflächenspannung von ursprünglichen 72 mN/m
- 67 % Emulgierungsaktivität
Die Details der Studie finden Sie in der wissenschaftlichen Veröffentlichung DOI 10.13140/RG.2.2.10802.35520 .
Kleinste Stellfläche 22 cm x 40 cm auch für Arbeitsvolumen bis zu 6 Liter!
Der Laborfermenter LAMBDA MINIFOR bietet mit den austauschbaren Reaktorgefässen Arbeitsvolumen ab 35 ml bis zu 6 Liter – und das auf einer Stellfläche von nur 22 cm x 40 cm. Die Laborfläche von kaum grösser als einem DIN A4 Blatt Papier reicht somit zur Produktion von signifikanten Mengen an Biotensiden für die Aufarbeitung und Analyse im DSP (down stream processing).
Wie wird das Biotensid aus der Fermenterbrühe extrahiert und aufgereinigt?
Wir sehen wieder über die Schultern der Forscher Ayoob Alshaikh Faqri, Nadhem Hayder und A. J. Hashim (6), um auch die Aufarbeitung des Produkts Biotensid Rhamnolipid zu verfolgen:
Das von P. aeruginosa im Fermenter produzierte Biotensid Rhamnolipid wird vom Bakterium in die Fermenterbrühe ausgeschieden. Für die Aufarbeitung des Überstands und zur Extraktion des Biotensids haben die Forscher folgende Verfahrensschritte im Down-Stream-Processing (DSP) eingesetzt:
- Zentrifugation zur Trennung vom Überstand (Medium mit Tensid) von der Biomasse
- Ausfällung bei pH = 2
- Zentrifugation zur Abtrennung der Fällung
- Extraktion des Überstands
- Aufkonzentrieren des Extrakts durch Verdampfung
Als Produkt erhielten die Forscher ein viskoses honigfarbenes Extrakt, dessen Ausbeute gravimetrisch in [g/l] bestimmt worden ist. Zur Reinigung der gewonnen Biotenside haben die Forscher eine Kieselgelchromatographie (Glaschromatographie 3.5 cm x 30 cm) gewählt.
(Die genauen Anleitung zur Extraktion und Reinigung der Biotenside finden Sie in der wissenschaftlichen Veröffentlichung DOI: 10.13140/RG.2.2.10802.35520.)
Welche Analysen sind zur Charakterisierung der Biotenside interessant?
Für den Einsatz der Biotenside als Wasch- und Reinigungsmitteln, wollen wir mehr zur herabgesetzten Oberflächenspannung, die kritische Mizellenkonzenration bzw. Mizellenverdünnung erfahren. Diese Werte liefern den Verbrauchern schlussendlich auch Aufschluss über die «Waschkraft» des Biotensids. Ebenfalls interessant in diesem Zusammenhang ist die antibakterielle Aktivität des Tensids.
Für die Herstellung und Preisgebung des Endprodukts ist die Ausbeute der Fermentation zudem auschlaggebend.
Standardanalysen & Charakterisierung der Biotenside
Folgende Trennverfahren und Analysemethoden sind bei der Bestimmung und Charakterisierung der Biotenside einsetzbar:
- Dünnschichtchromatographie (DC) zur Überprüfung der Franktionszusammensetzung
- Fourier-Transformations-Infrarotspektroskopie (FTIR) zur Spektralanalyse
- Wilhelmy-Platten-Methode zur Oberflächenspannungsmessung
- Kritische Mizellenkonzentration (CMC) & kritische Mizellenverdünnung (CMD)
- Trockengewichtszellbestimmung am Ende des Up-Stream-Processing (USP)
Die Methodik finden Sie in der wissenschaftlichen Veröffentlichung DOI: 10.13140/RG.2.2.10802.35520.
Bestimmung der Zytotoxizität von Mono-Rhamnolipiden
Im Weiteren haben die Forscher die antibakterielle Aktivität (Zytotoxizität) von Mono-Rhamnolipide gegen klinische Isolate grampositiver und gramnegativer Bakterien getestet:
- Bestimmung der antibakteriellen Aktivität von Mono-Rhamnolipid
gegen Staphylococcus aureus, Klebsiella pneumoniae, Proteus mirabilis, Streptococcus iniae, E. coli, Serratia marcescens und P. aeruginosa - Bestimmung der minimale Hemmkonzentration (MIC)
- Bestimmung der synergistischen Wirkung zusammen mit folgenden Antibiotika: Ampicillin, Cefotaxim, Gentamycin, Azithromycin, Tetracyclin, Vancomycin. (Ciprofloxacin als Referenz)
Rhamnolipid (RL) aus dem Fermenter & weitere interessante Aspekte
Die Forscher Ayoob Alshaikh Faqri, Nadhem Hayder und A. J. Hashim beantworten mit Ihrer Publikation DOI 10.13140/RG.2.2.10802.35520 (6) folgende Fragen:
In welcher Phase bildet P. aeruginosa das Biotensid Rhamnolipide?
Das von P. aerugionosa im Laborfermenter gebildete Biotensid Rhamnolipide (RL) ist ein Sekundärmetabolit, den das Bakterium in der stationären Phase ausscheidet:
Während die Trockenzellengewichte nach 24 Stunden bis ans Ende des Experiments (120 Stunden) nahezu konstant blieben, stiegen die RL-Konzentration und der Emulgierungsindex kontinuierlich an bzw. nahm die Oberflächenspannung allmählich ab.
Welche Rhamnolipide von P. aerugionosa haben die Forscher im Laborfermenter nachgewiesen?
Die Analysen des Bagdad University College of Science haben ergeben, dass das im Laborfermenter mit P. aeruginosa produzierte und durch die Aufreinigung erhaltene Biotensidgemisch hauptsächlich aus Mono-Rhamnolipiden und Di-Rhamnolipiden besteht.
Interessant sind dabei auch die Ergebnisse des Mono-Rhamnolipids, was die Zytotoxität angeht, womit sich weitere Anwendungen von Biotensiden erschliessen lassen.
Welche interessanten Anwendungsmöglichkeiten von Mono-Rhamnolipiden sind überprüft worden?
Nebst der Anwendung als waschaktive Substanz bzw. Tensid ist Mono-Rhamnolipid auch direkt als Hemmstoff gegen Bakterien und Zelllinien getestet worden.
Bei einer Mono-Rhamnolipidkonzentration von 250 µg/ml im Test gegen embryonale Rattenfibroblasten (REF) Zelllinien haben die Forscher eine Toxizität von 23 % gemessen.
Die durchgeführten Zytotoxitätstests ergeben für Mono-Rhamnolipide eine minimale Hemmkonzentration (MIC) von etwa 250 µg/ml. Sehr interessant sind zudem die Zytotoxizitätstests von Mono-Rhamnolipiden zeigten eine Kombinationswirkung mit Antibiotika:
- Mono-Rhamnolipide mit Ampicillin gegen Staphylococcus aureus und Serratia marcescens,
- Mono-Rhamnolipide mit Cefotaxim oder Tetracyclin gegen Echerichia coli und Klebsiella pneumoniae.
Referenzen:
(1) Noordman, W.H., Janssen, D.B.: Rhamnolipid stimulates uptake of hydrophobic compounds by Pseudomonas aeruginosa. Appl Environ Microbiol, 2002, 68, S. 4502-4508. DOI: 10.1128/AEM.68.9.4502-4508.2002
(2) Sotirova, A.V., Spasova, D.I., Galabova, D.N., Karpenko, E., Shulga, A: Rhamnolipid-biosurfactant permeabilizing effects on gram-positive and gram-negative bacterial strains. Curr Microbiol, 2008, 56, S. 639-644. DOI: 10.1007/s00284-008-9139-3
(3) Leitermann, F. P.: Entwicklung und Optimierung eines biotechnologischen Prozesses zur Herstellung mikrobieller Rhamnolipide auf Basis nachwachsender Rohstoffe. Dissertation. Universitätsverlag Karlsruhe, Karlsruhe, 2008. DOI: 10.5445/KSP/1000009236
(4) Van Delden, C., & Iglewski, B. H. (1998). Cell-to-Cell Signaling and Pseudomonas aeruginosa Infections. Emerging Infectious Diseases, 4(4), 551-560. DOI: 10.3201/eid0404.980405.
(5) Bodey, G.P., Bolivar, R., Fainstein, V., Jadeja, L.: Infections caused by Pseudomonas aeruginosa. Rev Infect Dis, 1983;5(2):279-313. doi: 10.1093/clinids/5.2.279.
(6) Faqri, A. F., Hayder, N.H. & Hashim, A.J.: Lab-scale production of Rhamnolipid by Pseudomonas aeruginosa A3 and study its synergistic effect with certain antibiotics against some pathogenic bacteria. Iraqi Journal of Agricultural Sciences –2019:50(5):1290-1301. DOI: 10.13140/RG.2.2.10802.35520.
Laborfermenter für den Einsatz an Universitäten: www.bioreactor.ch/6-wichtige-eigenschaften-des-minifor-bioreaktors-konstruiert-fuer-universitaeten-und-forschungslabors/
Schlagwörter: Biotenside, Rhamnolipide, Pseudomonas aeruginosa, Laborfermenter, Quorum Sensing, Zytotoxizität.


